Скачать (234 Kb)
Оглавление
1. Введение
2. Классификация методов люминесценции
2.1 По способу возбуждения
2.2 По длительности
2.3 По механизму свечения
3. Схемы Яблонского
4. Заключение
5. Список литературы
1. Введение
Все вещества при сильном нагревании начинают излучать электромагнитную энергию. Излучение нагретых веществ называют тепловым равновесным излучением. Однако некоторые вещества излучают электромагнитную энергию без нагревания – при комнатной температуре. Такое излучение называют люминесценцией, а люминесцентные вещества – люминофорами. В отличие от теплового, люминесценция является неравновесным излучением.
По В. Л. Левшину, люминесценция – это свечение атомов, молекул, ионов и других более сложных комплексов, возникающее в результате электронного перехода в этих частицах при их возвращении из возбужденного состояния в нормальное.
Метод молекулярной люминесцентной спектроскопии характеризуется высокой чувствительностью (порядок обнаружения 10-3 мг/мл), так как относится к силовым – выходной сигнал увеличивается с увеличением интенсивности источника излучения. В идеальных условиях удается достичь пределов обнаружения на уровне пикограммов в миллилитре.
В реферате приведена классификация методов люминесценции по способу возбуждения, механизму и длительности, описаны схемы Яблонского.
2. Классификация методов люминесценции
2.1 По способу возбуждения
Из определения люминесценции следует, что для её возбуждения необходимо подводить энергию извне, так как она теряется при излучении. Поэтому виды люминесценции естественно классифицировать по внешнему источнику возбуждения энергии.
|
Источник возбуждения
|
Вид люминесценции
|
|
Электромагнитное излучение видимой и ультрафиолетовой области спектра
|
фотолюминесценция
|
|
Поток электронов (катодные лучи)
|
Катодолюминесценция
|
|
Поток ионов щелочных металлов в вакууме
|
Ионолюминесценция
|
|
Рентгеновское излучение
|
Рентгенолюминесценция
|
|
Радиоактивное излучение
|
Радиолюминесценция
|
|
Тепловая энергия
|
Термолюминесценция (кандолюминесценция)
|
|
Ультразвук
|
Сонолюминесценция
|
|
Механическое воздействие
|
Триболюминесценция
|
|
Энергия химических реакций
|
Хемолюминесценция
|
|
Энергия биологических процессов
|
Биолюминесценция
|
Наиболее часто в аналитической практике используют фотолюминесценцию и хемилюминесценцию.
2.2 По длительности
Тип люминесценции зависит от того, какие переходы осуществляются в молекуле при поглощении ею квантов возбуждающего излучения.
Молекулярная люминесценция по длительности и спектральному составу:
- Флуоресценция (Фл)
кратковременная
замедленная - Фосфоресценции (Фс)
Испускание фотонов флуоресценции происходитпри переходе электрона с нулевого колебательного уровня состояния на любой колебательный уровень основного состояния. Флуоресценция является кратковременным излучением с длительностью 10-10-10-7 секунд и наблюдается при комнатной температуре. Энергия фотонов флуоресценции меньше энергии фотонов поглощения.
При определенных условиях (обычно при температуре -196 °С, в отсутствие парамагнитных молекул) для триплетных молекул оказывается возможнымзапрещенный переходс излучением фотонов фосфоресценции. Это излучение имеет значительно большую длительность 10-4-10-2 секунд. Энергия фотонов фосфоресценции меньше энергии фотонов кратковременной флуоресценции.
Помимо флуоресценции и фосфоресценции существует еще один вид люминесценции, который идентичен по спектральному составу флуоресценции, но характеризуется длительностью, свойственной фосфоресценции. Этот вид люминесценции называют замедленной флуоресценцией, поскольку перед излучением фотонов молекула некоторое время находится в триплетном состоянии.Этот тип молекулярной люминесценции наблюдается в весьма ограниченных диапазонах температур, вязкостей и концентраций растворов. По сравнению с флуоресценцией и фосфоресценцией ее интенсивность невелика и достигает максимальных значений при комнатной и более высоких температурах, заметно ослабевая с понижением температуры.
2.3 По механизму свечения
Свечение дискретных центров
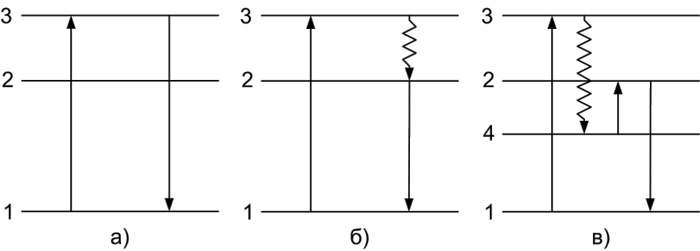
- резонансная (Рисунок 1а) – квант излучения, испускаемый частицей, равен поглощенному кванту.
- спонтанная (Рисунок 1б) – возникает при переходе частицы с возбужденного уровня 2 на основной уровень. Уровень испускания 2 лежит ниже уровня 3, поэтому излучаемый квант оказывается меньше поглощенного.
- вынужденная (Рисунок 1в) – возбужденная частица, прежде чем перейти на излучательный уровень 2, оказывается на промежуточном метастабильном уровне 4, непосредственный переход с которого на основной уровень является запрещенным. Для перехода на излучательный уровень 2 частице необходимо сообщить дополнительную энергию в виде тепла или света.
Рисунок 1. Схемы энергетических уровней и электронных переходов.
1 – основной уровень; 2, 3 – возбужденные уровни; 4 – метастабильный уровень; ↑ – поглощение; ↓ – люминесценция; 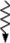 – безызлучательный переход.
– безызлучательный переход.
Поглощающими и излучающими центрами являются одни и те же частицы (атомы, ионы или молекулы). Этот вид свечения присущ в основном веществам в газообразном состоянии, органическим и неорганическим веществам в растворах и чистым органическим веществам.
Резонансная люминесценция характерна преимущественно для атомов, простейших молекул, находящихся в газообразном состоянии при низких давлениях, спонтанная — для паров и растворов сложных молекул, вынужденная — для сложных органических молекул, находящихся при низкой температуре или помещенных в вязкие или стеклообразные среды (полимерные пленки, сахарные леденцы).
Рекомбинационное свечение
Акты поглощения и излучения разделены не только во времени, но и пространственно. В процессе возбуждения происходит разделение частицы на две противоположно заряженные. Последовательность их рекомбинации сопровождается выделением энергии. Этот вид свечения является основным в свечении кристаллофосфоров – сложных кристаллических веществ с дефектной структурой.
3. Схемы Яблонского
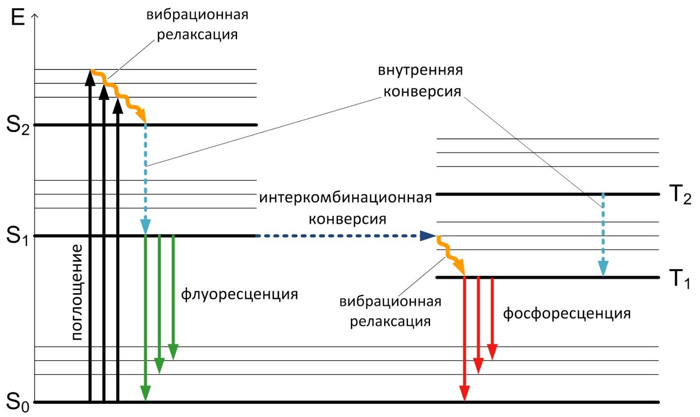
Поглощение и испускание света хорошо иллюстрирует диаграмма уровней энергии, предложенная Яблонским (Рисунок 2).
Рисунок 2. Диаграмма уровней энергии Яблонского
Основное, первое и второе электронные состояния обозначают S0, S1, и S2 соответственно.
Каждый из этих уровней энергии может состоять из множества колебательных энергетических уровней, обозначаемых 0, 1, 2 и т. д. Влияние растворителя во внимание не принимается.
Переходы между различными электронными уровнями обозначены вертикальными линиями. Такое представление используется, чтобы наглядно показать мгновенную природу поглощения света. Этот процесс происходит примерно за 10-15 с, время, слишком короткое для заметного смещения ядер (принцип Франка-Кондона).
В возбуждённых состояниях молекулы находятся очень недолго (в синглетном состоянии обычно значительно меньше, чем в триплетном) и становятся очень реакционноспособными.
В соответствии с распределением Больцмана, при комнатной температуре большинство молекул находятся на самом нижнем колебательном уровне основного синглетного состояния S0. Именно такие молекулы преимущественно и будут поглощать излучение.
Из-за большой разности энергий между уровнями S0 и S1 по существу, ни у каких флуорофоров состояние S1 не может быть заселено термическим путем. Даже малое термически активированное заселение первого возбужденного колебательного состояния молекул можно зарегистрировать, используя различие спектров поглощения при разных температурах.
За поглощением света обычно следует несколько других процессов. Возбуждение флуорофора, как правило, происходит до некоторого высшего колебательного уровня состояний (S1 либо S2).
3а некоторыми редкими исключениями, для молекул в конденсированной фазе характерна быстрая релаксация на самый нижний колебательный уровень состояния S1. Этот процесс называется внутренней конверсией и происходит большей частью за 10-12 с. Поскольку типичные времена затухания флуоресценции близки к 10-8 с, внутренняя конверсия обычно полностью заканчивается до процесса испускания. Следовательно, испускание флуоресценции чаще всего осуществляется из термически равновесного возбужденного состояния.
Аналогично поглощению обратный переход электронов на самый нижний электронный уровень также приводит к колебательно возбужденному состоянию. Термическое равновесие достигается за время порядка 10-12 с. Интересным следствием из такого рассмотрения является то, что спектр поглощения молекулы отражает колебательную структуру возбужденных электронных состояний, а спектр испускания — колебательную структуру основного электронного состояния. В большинстве случаев электронное возбуждение не сильно изменяет расположение колебательных уровней энергии. В результате этого колебательные структуры, проявляющиеся в спектрах поглощения и испускания, сходны.
Молекулы в состоянии S1 могут также подвергаться конверсии в первое триплетное состояние Т1. Испускание из Т1 называемое фосфоресценцией, обычно сдвинуто в сторону больших длин волн (меньших энергий) по сравнению с флуоресценцией. Конверсия из S1 в Т1 называется интеркомбинационной конверсией. Переход из Т1 в основное состояние запрещен, в результате чего константа скорости такого испускания на несколько порядков меньше соответствующей константы для флуоресценции.
На испускание флуоресценции могут влиять и другие факторы, не показанные в явном на диаграмме Яблонского: влияние растворителей, релаксация растворителя, тушение, а также реакции, происходящие в возбужденных состояниях.
4. Заключение
Люминесценция — один из видов излучения вещества, избыточного над тепловым излучением тела при данной температуре. Излучение наблюдается вследствие перехода электронно-возбужденных атомов, молекул, радикалов, ионов — так называемых центров люминесценции, в основное состояние. По длительности процесса излучения различают кратковременную люминесценцию, называемую флуоресценцией и медленную люминесценцию, называемую фосфоресценцией
В 1852 году Джордж Стокс установил, что длина волны фотолюминесценции больше длины волны возбуждающего света (правило Стокса). В 1864 году им предложено использование явления люминесценции для качественного анализа органических веществ. Широкое применение люминесцентные методы анализа получили в 30-е годы XX века благодаря работам Вавилова и его школы.
Процесс люминесценции может происходить в различных веществах, находящихся в разных агрегатных состояниях. Особенности излучения различных люминесцентных центров могут быть использованы в аналитических целях.
Для возбуждения люминесцентного центра могут быть использованы различные источники. Необходимым условием их эффективности является величина энергии излучения, которая должна быть достаточной для возбуждения электронного перехода в исследуемом веществе. Разные виды люминесценции находят применение в различных вариантах метода люминесцентного анализа.
Наиболее универсальный метод возбуждения люминесценции — фотовозбуждение исследуемого вещества. Он используется чаще всего как в атомных, так и в молекулярных методах анализа. При фотовозбуждении легко регулировать длину волны возбуждающего излучения, его интенсивность и поляризацию. При анализе многокомпонентной смеси возможно возбудить электронный переход, сопровождающийся люминесценцией только у одного из компонентов смеси. Таким образом, становится возможным проводить избирательный (селективный) анализ смеси веществ.
Наиболее широкое применение в аналитических целях имеет молекулярная фотолюминесценция для веществ, находящихся в растворе.
5. Список литературы
- А.А. Ищенко, М.А. Гольдштрах ЛЮМИНЕСЦЕНТНЫЙ АНАЛИЗ. Учебное пособие. М.: МИТХТ им. М.В.Ломоносова, 2009 — 36 с. ил.
- Основы аналитической химии. В 2 кн. Кн. 2. Методы химического анализа: Учеб. для вузов/Ю. А. Золотов, Е. Н. Дорохова, В. И. Фадеева и др. / Под ред. Ю. А. Золотова. — 3-е изд., перераб. и доп.- М.: Высш. шк., 2004. — 503 с: ил. — (Серия «Классический университетский учебник»).
- Столяров К. П., Григорьев Н. Н. Введение в люминесцентный анализ неорганических веществ. — Л., 1967. — 364 с.
- Фотобиофизика. Версия 1.0 [Электронный ресурс] : электрон. учеб. посо-бие / И. Е. Суковатая, В. А. Кратасюк, В. В. Межевикин и др. – Электрон. дан. (9 Мб). – Красноярск : ИПК СФУ, 2008.
Извините, ничего не найдено.