Аналитическая химия – раздел химии, изучающий способы формирования аналитического сигнала (выпадение осадка, выделение газа, изменение окраски).
Методы анализа:
- Химические – сигнал формируется за счет химической реакции, фиксируется визуально или органолептическим методом.
- Физико-химические – сигнал формируется за счет химической реакции, фиксируется инструментальными методами (ИК, УФ, ЯМР).
- Физические – воздействие физического фактора на молекулу (облучение).
В основе методов анализа – химическая реакция.
Химические методы анализа
По способу проведения реакции:
- Сухой
- Мокрый
По количеству вещества:
- Макроанализ, m>500мг
- Полумикроанализ, 0,1<m<500
- Микроанализ, 0,01<m<0,1
- Субмикроанализ, m<0,01
Растворы:
Идеальные – взаимодействия за счет Ван-дер-Ваальсовых сил.
Реальные:
- Солевой фон влияет на растворение вещества.
- Конкурирующая реакция – любая реакция, протекающая в системе помимо основной реакции и смещающая её равновесие в ту или иную сторону.
Химическое равновесие
Концентрации
a – активная концентрация
C – общая (аналитическая) концентрация
[C] – равновесная концентрация
Уравнение материального баланса: 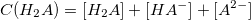
Константы химического равновесия
K0 – термодинамическая константа. Функция термодинамических величин: f (P, T, r, z). 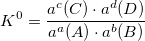
KN – концентрационная константа. Функция термодинамических величин и ионной силы раствора: f (P, T, r, z, I).
I – ионная сила раствора. Определяет концентрацию солевого фона. 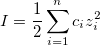
Коэффициент активности
Коэффициент активности (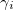 ) – степень отклонения активности иона от концентрации:
) – степень отклонения активности иона от концентрации: 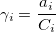
Средний ионный коэффициент активности (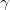 ) – отражает поведение раствора в целом.
) – отражает поведение раствора в целом.
Для нейтральных молекул средний коэффициент примерно равен 1.
Закон Дебая-Хюккеля
При I<0,01М: 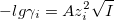 . Для водных растворов при 20°С A=0,5:
. Для водных растворов при 20°С A=0,5: 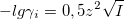
При I<0,1М: 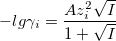
Уравнение Дэвиса
При 0,1<I<1: 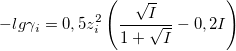
Солевые фоны увеличивают константу химического равновесия.
Таким образом,
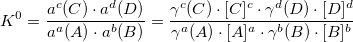
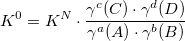
K’ – условная константа равновесия. Функция термодинамических величин, ионной силы раствора, pH раствора и других величин: f (P, T, r, z, I, pH…).
Описывает систему в реальных условиях.
Коэффициент конкурирующей реакции
α – коэффициент конкурирующей реакции, функция распределения ионной формы в растворе, мольная доля: 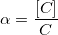
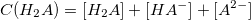
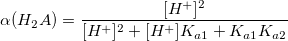
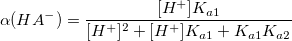
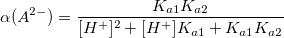
В общем виде:
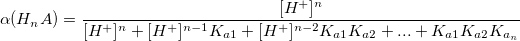
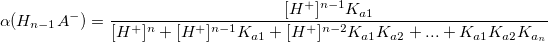
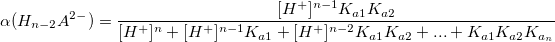
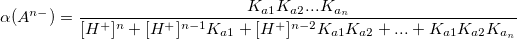
Таким образом,
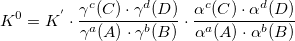
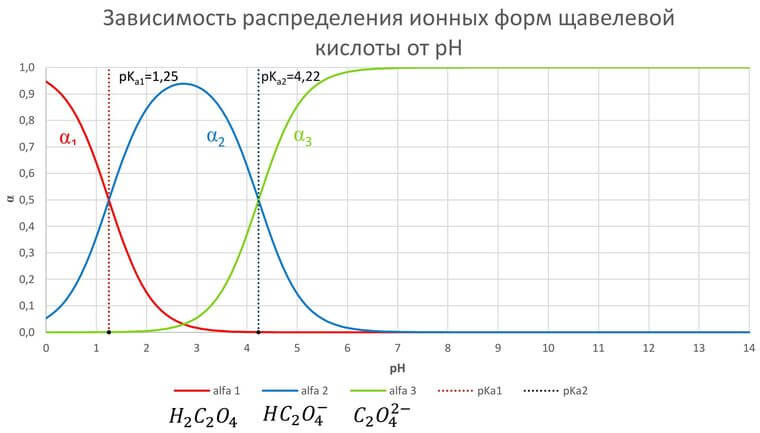
Графическое описание равновесий
Распределительная диаграмма – график зависимости молярных долей компонентов от параметра, влияющего на равновесие. Кривые ограничивают области, в которых доминируют те или иные частицы.
Смотрите график зависимости распредления ионных форм щавелевой кислоты от pH в формате xlsx (excel)
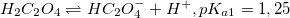
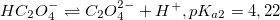
При низком pH доминирует недиссоциированная форма H2C2O4. С увеличением pH возрастает концентрация HC2O4–. Первому пересечению при pH=pKa1=1,25 соответствует равенство концентраций H2C2O4 и HC2O4–, второму (pH=pKa2=4,22) – HC2O4– и C2O42–. При pH больше 5 доминирует C2O42–.