Растворы:
- твердые (сплавы) – нет границы раздела фаз
- газообразные
- жидкие:
- молекулярные – за счет физико-химических взаимодействий образуются ассоциаты между растворителем и растворенным веществом.
- идеальные – взаимодействия за счет Ван-дер-Ваальсовых сил
- ионные – химические взаимодействия между растворителем и растворенным веществом, что приводит к ионизации растворенных веществ.
Протолитическое равновесие – равновесие кислота/основание.
HS (H – водород, S – solvent, растворитель)
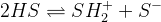
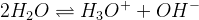
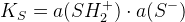 – констаната автопротолиза растворителя
– констаната автопротолиза растворителя
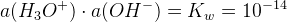
Константа автопротолиза определяет шкалу кислотности.
Теория Аррениуса, Льюиса, Усановича.
Теория Бренстеда-Лоури
Кислота (А, диспроид) – частица, поставляющая в раствор протоны:
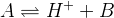
A – кислота, B – сопряженное основание
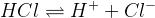
HCl – кислота, Cl– — сопряженное основание
A: Кислоты, некоторые катионы, кислые соли слабых кислот.
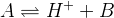 ,
, 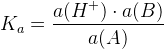 – константа кислотности
– константа кислотности
Основание (B, эмпротив) – частица, способная присоединять протоны, превращаясь в сопряженную кислоту:
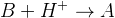
B – основание, A – сопряженная кислота
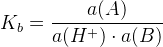 – константа основности
– константа основности
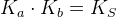
- Кислотные и основные свойcтва кислотно-основных сопряжнных пар находятся в обратно пропорциональной зависимости.
- Равновесие без растворителя не устанавливается.
- Любая кислотно-основная реакция включает в себя, как минимум, две кислотно-основные пары.
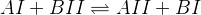 – кислотно-основное равновесие
– кислотно-основное равновесие - BII может быть растворитель
- Все зависит от свойств растворителя.
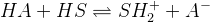
- Основа неводного титрования.

