Смотрите также правила уравнивания окислительно-восстановительных реакций
Ox – окисленная форма
Red – восстановленная форма
Уравнение Нернста
E0 (стандартный электродный потенциал) – справочная величина для каждой редокс пары, ЭДС гальванического элемента, одним из электродов которого является нормальный водородный электрод (н. в. э.), а вторым – определяемая система.
Н.В.Э. (Нормальный водородный электрод) – Pt|H2SO4 (0,1 м), H2 (1 атм)|| 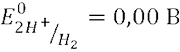
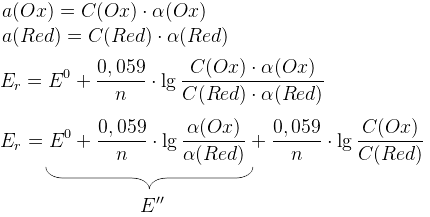
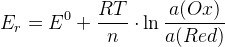 – уравнение Нернста
– уравнение Нернста
Er – равновесный электродный потенциал
n – число отданных или присоединенных электронов
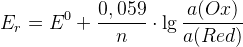
Равновесный электродный потенциал определяется числом электронов и концентрациями Ox и Red. Если a(Ox)=a(Red), то Er=E0Ox/Red.
Идеальная система 
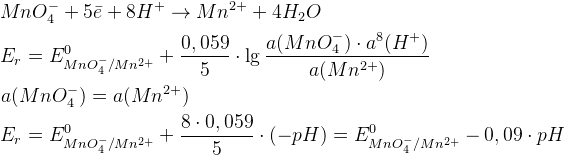
- Чем больше pH, тем больше Er
- Сильные окислители работают в сильно кислых средах
- Необходимое условие прохождения ОВР – положительная разность потенциалов
- Окислители и восстановители тем сильнее, чем больше |E0|
Неидеальная система
1. Солевой фон 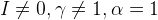
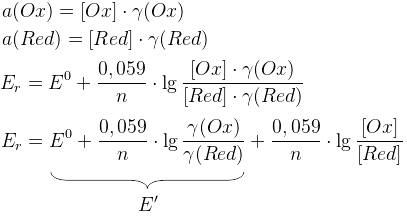
E’ – реальный редокс потенциал (E0 в условии наличия солевых фонов)
2. Конкурирующие реакции 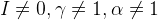
E’’ – формальный редокс потенциал (E0 в условии наличия солевых фонов и конкурирующих реакций)
Факторы, влияющие на равновесный электродный потенциал
Кислотность среды
1. Для окисленной формы

Если n=1:
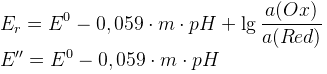
Для одноэлектронных переходов увеличение pH уменьшает E’’
Если Er зависит от pH, то окислители в кислой среде имеют больший потенциал, чем в щелочной
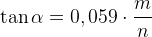
2. Для восстановленной формы
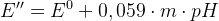
Конкурирующая реакция
1. 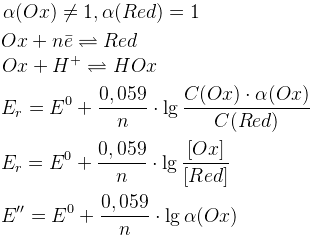
2. 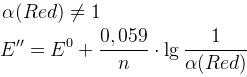
Комплексообразование
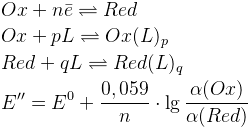
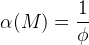
Φ – функция закомплексованности Фронеуса
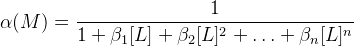
β – константа устойчивости, [L] – концентрация лиганда
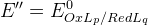
Чем устойчивее комплекс, тем больше влияние
Осаждение
Для восстановленной формы: 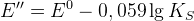
Для окисленной формы: 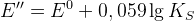
Если осаждение по восстановленной форме, то E’’ уменьшается на величину KS
Чем менее растворим осадок, тем больше влияние
Константа скорости ОВР
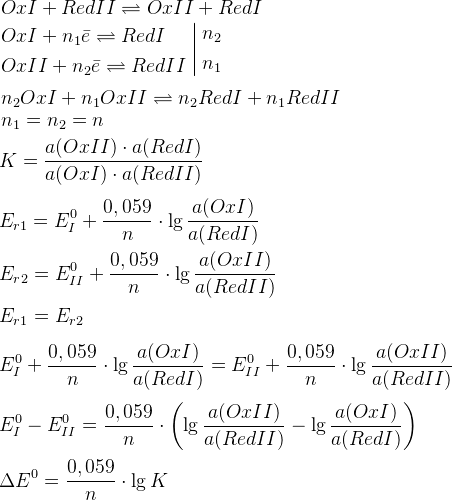
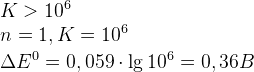
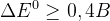 – условие протекания ОВР
– условие протекания ОВР
Реакции, не подчиняющиеся уравнению Нернста даже при повышенных концентрациях
необратимые системы
многоэлектронные переходы
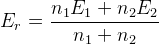
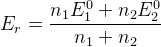 – для идеальной системы
– для идеальной системы
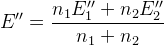 – в реальных условиях
– в реальных условиях

